tugassains.com – Kemunculan teori asam basa yang diungkapkan oleh bronsted-lowry pada tahun 1923 , yaitu setelah kemunculan teori asam basa arrhenius dan sebelum teori asam basa lewis dikemukakan.
Teori yang diungkapkan bronsted-lowry memiliki banyak kelebihan dibandingkan teori milik arrhenius, karena dapat bekerja pada pelarut selain air sehingga lebih luas ruang lingkup senyawanya.
Dikemukakan oleh dua orang kimiawan yaitu Bronsted dan Lowry yang masing-masing Johanes Nicolaus Bronsted berkebangsaan Denmark dan Thomas Martin Lowry berkebangsaan Britania Raya.
Menurut bronsted-lowry asam adalah zat yang menyumbangkan proton atau ion Hidrogen (H+) membentuk basa konjugasi, sedangkan basa adalah yang menerima proton atau ion Hidrogen (H+) dan membentuk asam konjugasi.
Asam Bronsted-Lowry
Pada asam berdasarkan teori bronsted-lowry merupakan zat yang menyumbangkan proton atau ion Hidrogen.
Asam ⇌ Proton + Basa Konjugasi
Misalnya pada beberapa senyawa berikut:
HBr ⇌ H+ +
Br– HCl ⇌ H+ + Cl–
HClO4 ⇌ H+ + ClO4–
Basa Bronsted-Lowry
Sebuah zat dikatakan asam menurut bronsted-lowry apabila zat tersebut menerima proton atau ion Hidrogen.
Basa + Proton ⇌ Asam Konjugasi
Misalnya pada beberapa senyawa berikut:
OH– + H+ ⇌ H2O
NH3 + H+ ⇌ NH4+
Contoh asam basa oleh brosted-lowry dapat kita ketahui pada reaksi Asam Nitrat (HNO3) yang dilarutkan didalam Air (H2O) berikut:
Pada reaksi tersebut dapat kita ketahui bahwa HNO3 berperan sebagai asam karena menyumbangkan proton (H+) kepada H2O. Sehingga H2O berperan sebagai basa karena menerima
proton (H+) dari HNO3.
Pada sisi kanan (H3O+) merupakan asam konjugasi dari H2O sedangkan (NO3–) merupakan basa konjugasi dari HNO3.
Air H2O bersifat amfoter, yaitu dapat bersifat sebagai asam bronsted-lowry atau basa bronsted-lowry.
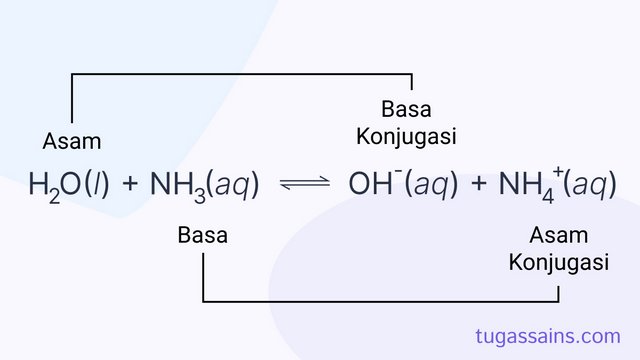
Dari reaksi antara Amonia dengan Air tersebut tentukanlah mana yang berperan sebagai asam dan basa serta asam konjugasi juga basa konjugasinya.
H2O(l) + NH3(aq) ⇌ OH–(aq) + NH4+(aq)
Dapat kita uraikan bahwa NH3 sebagai basa karena menerima proton (H+) dari H2O, sehingga H2O bersifat sebagai basa karena menyumbangkan proton (H+) kepada NH3.
Pada sisi kanan ion (OH–) merupakan basa konjugasi dari H2O dan (NH4+) adalah asam konjugasi dari NH3.
Sehingga pada teori bronsted-lowry dapat kita simpulkan bahwa:
- Asam adalah zat yang menyumbangkan proton kepada senyawa lain
- Basa adalah zat yang menerima proton dari senyawa lain
- Air dapat menjadi asam ataupun basa, karena air bersifat amfoter.
Semoga bermanfaat.