tugassains.com – Dalam perhitungan larutan kimia digunakan berbagai rumus yaitu seperti perhitungan molaritas dan perhitungan molalitas yang berkaitan erat antara hubungan larutan dengan pelarut.
Sehingga pada artikel ini kita akan belajar mengenai apa itu perhitunganmolalitas dan bagaimana mencari besar molalitas pada suatu larutan dengan menggunakan rumus dan contoh soal pembahasan.
Pengertian Molalitas
Molalitas Larutan dinyatakan sebagai besar mol terlarut terhadap satu kilogram pelarut atau 1.000 gram pelarut, sehingga dapat kita identikan sebagai besar konsentrasi mol terlarut terhadap 1 kg massa pelarut.
Satuan dari molalitas adalah molal atau mol/kg.
Perlu diperhatikan bahwa molalitas berbeda dengan molaritas karena molaritas merupakan konsentrasi pelarut terhadap volume sedangkan molalitas konsentrasi pelarut terhadap massa pelarut.
Baca juga: Contoh Soal Menghitung Konsentrasi Larutan dalam Persen
Rumus Molalitas Larutan
Besar Molalitas larutan dihitung secara sederhana sebagai mol zat terlarut dibagi dengan massa zat pelarut dalam kilogram, atau kita tuliskan sebagai:
m = n / p
keterangan:
m : molalitas (molal atau mol/kg)
n : mol zat terlarut (mol)
p : massa zat pelarut (kg)
Atau apabila massa pelarut yang kita akan cari dalam bentuk gram, kita akan menggunakan rumus berikut:
Keterangan:
m : molalitas (mol/kg)
g : massa zat terlarut (g)
Mr : massa molekul relatif (g/mol)
P : massa pelarut (g)
molalitas dinotasikan sebagai “m”.
Untuk dapat memahami lebih jauh, selanjutnya kita akan melatihnya dengan contoh soal yang disertai dengan pembahasan berikut.
Baca juga: Rumus Pengenceran dan Cara Mengencerkan Larutan
Contoh Soal Molalitas
1. Hitunglah besar molalitas dari larutan yang terdiri dari 7 mol NaCl pada 10 kg pelarut!
diketahui:
n = 7 mol
p = 10 kg
ditanya: besar molalitas larutan NaCl (m)?
penyelesaian: dengan membagi antara besar mol terhadap massa pelarut untuk mengetahui besarnya.
m = n/p
= 7/10
= 0,7 mol/kg
Jadi molalitas larutan NaCl tersebut sebesar 0,7 mol/kg.
2. Jika diketahui sebuah larutan HCl sebanyak memiliki besar molalitas sebesar 20 mol/kg. Hitunglah berapa besar mol HCl yang terlarut apabila massa pelarut sebesar 4 kg?
diketahui:
m = 20 mol/kg
p = 4 kg
ditanya: besar mol HCl yang terlarut (n)?
penyelesaian: dengan subtitusi kedalam rumus molalitas, kita dapat menghitung besar mol HCl.
m = n/p
n = m × p
= 20 × 4
= 80 mol
Jadi besar mol HCl yang terlarut sebesar 80 mol.
3. Sebanyak 234 gram NaCl akan dilarutkan pada pelarut yang memiliki massa 500 gram, hitunglah besar molalitas larutan tersebut (Ar: Na = 23, Cl = 35,5)
diketahui:
g = 234 gram
P = 500 gram
ditanya: besar molalitas larutan NaCl (m)?
penyelesaian: Mencari nilai Mr dari NaCl terlebih dahulu.
Mr NaCl = (1 × Ar Na) + (1 × Ar Cl)
= 23 + 35,5
= 58,5
kemudian menghitung besar m dengan menggunakan rumus.
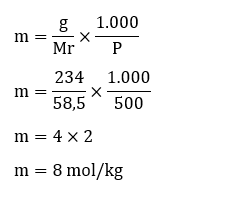
Jadi besar molalitas larutan NaCl tersebut sebesar 8 mol/kg.
4. Sebuah pengolahan air akan melakukan pejernihan air menggunakan Aluminium Sulfat Al2(SO4)3 memerlukan 10 mol/kg. Apabila akan menjernihkan 10 kg air maka memerlukan berapa massa
Al2(SO4)3 yang diperlukan (Ar: Al = 27, S = 32, O = 16)?
diketahui:
m = 10 mol/kg sehingga untuk 10 kg air
m10 = 10 × 10
m10 = 100 mol/kg
p = 10 kg
ubah dalam gram
P = 10.000 g
ditanya: massa Aluminium Sulfat yang diperlukan (g)?
penyelesaian: Untuk menyelesaikan, mari kita hitung terlebih dahulu besar Mr Aluminium Sulfat.
Mr Al2(SO4)3 = (2 × Ar Al) + (3 × Ar S)
+ (12 × Ar O)
= (2 × 27) + (3 × 32) + (12 × 16)
= 54 + 96 + 192
= 242 g/mol
Selanjutnya menghitung besar massa Aluminium Sulfat yang dibutuhkan dengan menghitung nilai g.
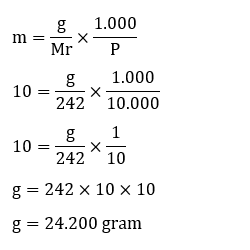
Jadi massa Aluminium Sulfat yang dibutuhkan yaitu sebanyak 2.420 gram.
Baca juga: Menghitung Konsentrasi Larutan ppm dan ppb
Semoga bermanfaat.





